Unterrichtsinhalte
| Chemie: von Klasse 7 bis Klasse 10 | nicht eingeloggt |
Unterrichtsinhalte Chemie in der Realschule nach alten Lehrplänen
Themenbereiche:
Klasse 7 Klasse 8 Klasse 9 Klasse 10 Liste der Experimente Exkursionen
Klasse 7
1 Verhalten im Chemieraum



Sicherheit im Unterricht: Regeln für den Chemieraum
- Chemieraum nur mit Aufsichtsperson betreten, Essen und Trinken ist verboten
- Schutzbrille ist immer Pflicht, lange Haare zum Zopf zusammenbinden
- Versuchsanleitung genau durchlesen und beachten
- Chemikalien und Geräte erst mit Erlaubnis des Lehrers holen
- Geräte müssen stabil und sicher stehen, sie müssen sorgfältig behandelt werden und nach dem Versuch gereinigt in die vorgesehenen Schränke zurückgestellt werden
- Geschmacksproben sind verboten, bei Riechproben vorsichtig zufächeln, sie dürfen nicht mit den Fingern angefasst werden
- Chemikalien dürfen nur in Chemikaliengefäßen aufbewahrt werden, nicht in Lebensmittelgefäße
- mit so wenig Chemikalien wie möglich arbeiten
- Chemikalienreste niemals zurück in die Vorratsgefäße gießen, sie müssen fachgerecht entsorgt werden und dürfen nicht in den Ausguss entsorgt werden
Richtiger Umgang mit dem Gasbrenner
Kennenlernen der Experimentiergeräte
richtiger Umgang mit Chemikalien
fachgerechte Entsorgung von Chemikalien
Protollieren von Experimenten
- Überschrift des Versuchs (Versuchsbezeichnung)
- These/Fragestellung
- Benötigte Geräte
- Benötigte Chemikalien
- Versuchsaufbau (Versuchsdurchführung)
- Beobachtung
- Erklärung (Ergebnis, Deutung)
2 Stoffeigenschaften – Stoffveränderungen



Die Schüler sollen
- Stoffeigenschaften kennenlernen u. experimentell unterscheiden
- Aggregatzustände und deren Übergänge kennen
- Stoffe aus kleinsten Teilchen bestehen und eine Eigenbewegung ausführen
Welche Stoffeigenschaften können wir mit unseren Sinnen erkennen?
- Härte (Tastsinn)
- Oberflächenbeschaffenheit (Tastsinn, Sehsinn)
- Wärmeleitfähigkeit (Tastsinn)
- Farbe (Sehsinn)
- Glanz (Sehsinn)
- Aggregatzustand (Sehsinn)
- Geruch (Geruchssinn)
- Geschmack (Geruchssinn und Geschmackssinn)
- Klang (Gehörsinn)
Welche Stoffeigenschaften können nur mit Hilfsinstrumenten gemessen werden?
- Radioaktivität (Geiger-Zähler)
- Schmelzpunkt / Schmelztemperatur (Thermometer)
- Siedepunkt / Siedetemperatur (Thermometer)
- Löslichkeit (Waage + Lösungsmittel)
- Dichte = Masse durch Volumen (Waage, Wasserverdrängung)
- Elektrische Leitfähigkeit (Leitfähigkeitsprüfer)
- Magnetismus (Magnet)
- Brennbarkeit (Entzündbarkeit testen)
- Zündtemperatur (Thermometer)
2.1 Stoffe erkennt man an ihren Eigenschaften



(Farbe, Geruch, Geschmack, Oberfläche, Klang, Löslichkeit, Härte)
2.2 Stoffeigenschaften kann man messen



(Wärme- u. elektr. Leitfähigkeit, Schmelz- u. Siedetemperatur, Aggregatzustände und deren Übergänge)
2.3 Stoffgruppen und Steckbriefe



Jeder Stoff besitzt typische, nur für ihn geltende Eigenschaften. Diese Eigenschaften können in Form von Steckbriefen dargestellt werden:
Stoffsteckbriefe erstellen:
- Aussehen
- Geruch
- Härte
- Verformbarkeit
- Elektrische Leitfähigkeit
- Magnetisierbarkeit
- Löslichkeit in Wasser
- Dichte
- Schmelztemperatur
- Siedetemperatur
Stoffe aufgrund ihrer Eigenschaften in Stoffgruppen einteilen:
- Metalle und Nichtmetalle
- Aggregatzustände (fest, flüssig, gasförmig)
2.4 Stoffe bestehen aus kleinsten Teilchen



Wie kann man beweisen, dass Stoffe wirklich aus "kleinsten Teilchen" bestehen?
(Brownsche Bewegung, Diffusion, Osmose, Kugelteilchenmodell)
3 Mischen und Trennen von Stoffen



Die Schüler sollen
- Stoffgemische nennen und Beispiele anführen
- Trennverfahren durchführen und die zur Trennung genutzte Eigenschaft angeben
- Trennverfahren des Alltags und der Technik nennen
3.1 Stoffgemische



(Gemenge, Gemisch, Lösung, Suspension, Emulsion, Legierung, Rauch, Schaum, Nebel)
3.2 Trennverfahren



Wie funktioniert eine Kläranlage?
Die meisten Kläranlagen besitzen drei Reinigungsstufen:
- Die mechanische Klärstufe
- Die biologische Klärstufe
- Die chemische Klärstufe
Mechanische Klärstufe
- Rechen: Mithilfe eines oder mehrerer Rechen werden grobe Verschmutzungen, z.B. Laub, Kunststoff, Papier/Pappe, Kadaver, Äste usw. aus dem Abwasser herausgerecht. Ein Rechen ist ein kammartiges Gebilde, an dessen Zinken die groben Verschmutzungen hängen bleiben. Diese Verschmutzungen werden immer wieder vom Rechen abgestreift und in einem Abfallkontainer entsorgt. Neben einem Grobrechen gibt es noch einen Feinrechen. Beim Grobrechen stehen die Zinken weiter auseinander. Nur grober Abfall bleibt hängen. Beim Feinrechen stehen die Zinken näher beieinander, wodurch auch feinerer Schmutz hängen bleibt.
- Sandfang: Das Abwasser wird verlangsamt. Stoffe mit einer höheren Dichte sinken auf den Boden ab (Sedimentieren). Das Abwasser fließt anschließend über eine Kante weiter in den Ölabscheider (Dekantieren).
- Ölabscheider: Wie bei einem Soßenkännchen fließt das Abwasser durch eine untere Öffnung in das Vorklärbecken (Abscheiden). Öle und andere Stoffe mit einer geringeren Dichte schwimmen oben und gelangen in ein Sammelbecken für diese Stoffe, indem sie über eine Kante abfließen können.
- Vorklärbecken: In einem meist runden, trichterförmigen Becken sinken feinste Schwebteilchen in die untere Trichteröffnung und werden abgepumpt. Von dort gelangen diese Schwebteilchen in den Faulturm.
Biologische Klärstufe
- Belebungsbecken: Luft wird in das Abwasser geblasen. Die im Abwasser befindlichen Bakterien erhalten dadurch viel Luft zum Atmen. Sie fressen die organischen Bestandteile des Abwassers auf. Dabei entsteht Kohlenstoffdioxid und Wasser.
- Nachklärbecken: Ähnlich wie im Vorklärbecken werden hier die abgestorbenen Bakterien vom Abwasser getrennt. Die Bakterien gelangen dann in die Faultürme. Dies geschieht vor allem durch das Einblasen von Luft (Flotieren).
Chemische Klärstufe
- Chemikalienzugabe: Viele Kläranlagen besitzen eine chemische Klärstufe, wodurch Chemikalien aus dem Abwasser entfernt werden können. Zwei grundsätzliche Verfahren werden unterschieden:
- Aktivkohle: Gereinigtes Abwasser wird mit Aktivkohle vermischt. Die große Oberfläche der Aktivkohle bindet die wasserlöslichen Chemikalien (Adsorbieren). Anschließend sedimentiert die Aktivkohle und wird in einem Nachklärbecken entfernt und anschließend entsorgt.
- Fällung: Fällungschemikalien werden zum Abwasser hinzu gegeben. Die wasserlöslichen Chemikalien werden dadurch wasserunlöslich und sinken zu Boden. Mithilfe dieses Verfahrens werden Phosphate (Dünger) durch die Zugabe von z.B. Eisen(III)-chlorid ausgefällt.
Faulschlamm
- Faultürme: Unter Luftabschluss faulen die zumeist organischen Abfälle aus dem Vor- und Nachklärbecken. Beim Faulprozess entsteht Methangas, das für Heizzwecke und zur Stromerzeugung verbrannt wird. Die entwässerten festen Reste des Faulschlamms werden in Verbrennungsanlagen entsorgt.
Weitere Trennverfahren:
- Auslesen: Von Hand werden die Stoffe getrennt.
- Filtrieren: Der feste Stoff wird vom flüssigen Stoff durch den Filter getrennt. Der Filter ist aus sehr, sehr vielen winzigen Löchern aufgebaut. Zwischen den Löchern befindet sich das eigentliche Filtermaterial, z.B. Papier oder Metall. Die Löcher sind so klein, dass nur bestimmte Stoffe hindurch gelangen. Größere Teilchen bleiben hängen.
- Eindampfen: Ein Stoffgemisch aus einem Lösungsmittel und einem gelösten Stoff (z.B. Salzwasser) kann mithilfe des Eindampfens getrennt werden. Das Lösungsmittel verdampft, der gelöste Stoff bleibt zurück. Damit das Eindampfen erfolgreich sein kann, muss der Siedepunkt des Lösungsmittels wesentlich niedriger liegen als der des gelösten Stoffes. Dadurch verdampft als erstes das Lösungsmittel. Siedepunkt Wasser: 100 °C, Siedepunkt Kochsalz: ca. 1465 °C
- Destillieren
- Extrahieren
- Chromatografieren: Mithilfe der Chromatografie kann man Stoffe in ihre Bestandteile zerlegen. Dies geschieht dadurch, dass der zu untersuchende Stoff auf einer Trägersubstanz (z.B. Filterpapier) aufgebracht wird. Ein Lösungsmittel (z.B. Wasser) breitet sich anschließend auf der Trägersubstanz aus und trägt die einzelnen Bestandteile des Stoffes unterschiedlich weit mit. Diese einzelnen Bestandteile können anschließend getrennt von den anderen weiter untersucht werden. Neben der Papierchromatografie gibt es noch: Gaschromatografie, Säulenchromatografie...
- Zentrifugieren: In einer Zentrifuge werden die Vorgänge des Sedimentierens beschleunigt. Dazu wird z.B. ein Reagenzglas mit Schlamm in die Zentrifuge eingespannt. Es dreht sich nun rasend schnell im Kreis. Die Stoffe mit der höchsten Dichte fliegen aufgrund der Fliehkraft (Zentrifugalkraft) nach Außen. Da sich Reagenzglas während des Zentrifugierens waagerecht ausrichtet, sinken die Stoffe mit der höchsten Dichte auf den Boden des Reagenzglases. Die übrigen Stoffe bleiben darüber.
Weitere Anwendungen im Alltag:
- Vom Steinsalz zum Kochsalz
- Kaffee kochen
4 Wasser



Die Schüler sollen
- die Gewinnung von Trinkwasser beschreiben
- Verbrauch und Abwasserproblematik diskutieren
- Verhaltensmodifikation beim Wasserverbrauch erfahren
- Die Zusammensetzung des Wassers kennen
- die Knallgasprobe durchführen
- die Begriffe Analyse und Synthese definieren
Warum siedet Wasser in Jülich / Aldenhoven bereits bei 98 °C und nicht bei 100 °C?
Aldenhoven liegt ca. 114 m über dem Meeresspiegel. Der Luftdruck in Aldenhoven ist daher etwas kleiner als am Meer. Die Luftteilchen drücken gegen die Wasserteilchen, die aus dem Becherglas als Wasserdampf aufsteigen möchten. Dieser geringere Gegendruck sorgt dafür, dass das Wasser in Aldenhoven bereits bei ca. 98 °C siedet und nicht erst bei 100 °C. Der Wert 100 °C ist ein normierter Wert, der bei Standardluftdruck (1013 hPa) und Standardhöhe (0 m über dem Meeresspiegel) gemessen wurde.
4.1 Gewinnung des Trinkwassers



4.2 Wasserverbrauch im Alltag



4.3 Wasserverschmutzung, Aufbau einer Kläranlage



4.4 Zusammensetzung des Wassers



5 Luft



Die Schüler sollen
- die Zusammensetzung der Luft nennen
- Schadstoffbelastung der Luft erklären
- die Begriffe Emission und Immission definieren
5.1 Zusammensetzung der Luft



5.2 Schadstoffbelastung



5.3 Maßnahmen gegen die Luftverschmutzung



Klasse 8
1 Chemische Reaktion



Die Schüler sollen
- beschreiben, dass chemische Reaktionen mit Energieumsätzen verbunden sind
- Oxidation als chemische Reaktion mit Sauerstoffaufnahme, Reduktion als Sauerstoffabgabe formulieren können
- angeben können, dass bei einer Reduktion beides gleichzeitig stattfindet
- DALTONS Atomvorstellung zur Deutung chemischer Reaktionen heranziehen
- angeben, dass Moleküle aus Atomen zusammengesetzt sind
- beschreiben, dass Verbrennungsprodukte mit Wasser saure und alkalische Lösungen bilden
Man spricht von einer Chemischen Reaktion
, wenn die Teilchen, aus denen mindestens ein Ausgangsstoff (Edukt) besteht, sich umorganisieren zu mindestens einem neuen Endstoff (Produkt) mit neuen Eigenschaften.
1.1 Die Verbrennung



Zu einer Verbrennung gehören immer drei Bedingungen, die erfüllt sein müssen:
- Brennstoff (ein Stoff, der brennbar ist)
- Sauerstoff (in der Luft ist Sauerstoff, ein Gas, enthalten)
- Energie (die Zündtemperatur des Brennstoffes muss überschritten werden)
(Glimmspanprobe, Kalkwasserprobe, Vorgänge in der Kerzenflamme, Entzündungstemperatur, Zerteilungsgrad, Staubexplosion, Oxidation, Reduktion)
1.2 Gewinnung von Metallen



Oxidation
- Aufnahme von Sauerstoff
- Abgabe von Elektronen
- Oxidationsmittel: der Stoff, der den Sauerstoff liefert bzw. Elektronen aufnimmt
- Beispiel: Metall + Sauerstoff ⇋ Metalloxid
Reduktion
- Abgabe von Sauerstoff
- Aufnahme von Elektronen
- Reduktionsmittel: der Stoff, der den Sauerstoff aufnimmt bzw. Elektronen abgibt
- Beispiel: Metalloxid ⇋ Metall + Sauerstoff
Wenn Reduktion und Oxidation gleichzeitig ablaufen, spricht man von einer Redox-Reaktion.
Experimente zur Metallgewinnung:
Reduktion von Kupferoxid mit Holzkohle
Reduktion von Kupferoxid mit Eisenpulver
2 Energie und Umwelt



Die Schüler sollen
- fossile Energieträger nennen
- Alkane als Kohlenwasserstoffe beschreiben
- angeben, dass bei der Verbrennung fossiler Brennstoffe mehrere Reaktionsprodukte entstehen
- die Entstehung des sauren Regen als eine Reaktion der Verbrennungsprodukte mit dem Regenwasser formulieren
- Maßnahmen zur Energieeinsparung angeben
2.1 Fossile Energieträger



Die Schülerinnen und Schüler sollen...
- verschiedene fossile Energieträger nennen können,
- die Entstehung der Energieträger erklären können,
- die wichtigsten Verwendungszwecke beschreiben können,
- die Bedeutung von Erdöl für das 20. und 21. Jahrhundert begründen können.
(Braunkohle, Steinkohle, Erdöl, Erdgas)
Erdöl
Entstehung von Erdöl
Plankton und andere Kleinstlebewesen sinken nach ihrem Absterben auf den Meeresgrund. Ab einer Meerestiefe von über 200 m gelangt kein Sauerstoff an die abgestorbenen Lebewesen, welche deswegen nicht verwesen. Diese Masse vermischt sich mit Sand und Ton; es entsteht das sogenannte Erdölmuttergestein. Dieses wird über Jahrmillionen mit weiteren Gesteinsschichten überdeckt, die für einen enormen Druck und hohe Temperaturen sorgen. Die langen Kohlenwasserstoffketten im Muttergestein zerbrechen. Aufgrund ihrer geringeren Dichte und Verformungen der Gesteinsschichten steigt dieses Gemisch aus Kohlenwasserstoffen im porösen Muttergestein nach oben, bis es eine Sperre aus Ton oder Salz erreicht. Es kann nicht weiter aufsteigen. Es bildet sich eine Erdölblase - eine Erdöllagerstätte. Der Entstehungsvorgang von Erdöl dauert ca. 300 Mio. Jahre.
Wie kann man Erdöllagerstätten finden und das Erdöl fördern?
- Luftfotografie: Durch Luftaufnahmen über Gebiete wie z.B. den Iran erkennt man mögliche Erdöllagerstätten aufgrund von Gesteinsformationen.
- Geophysikalische Untersuchungen: Man nimmt Gesteinsproben, die dann im Labor untersucht werden. Wenn die Gesteinsproben Erdölspuren enthalten oder das passende Alter haben, dann wird dieses Gebiet weiter untersucht.
- Reflexionsseismik: Man erzeugt Sprengungen an der Erdoberfläche. Diese erzeugen Schwingungen, die sich in alle Richtungen gleichmäßig im Erdboden ausbreiten. Diese Wellen werden von allem möglichen, worauf sie treffen, reflektiert. Mithilfe von hochempfindlichen Mikrofonen werden die Reflektionswellen gemessen. Anhand der Messergebnisse kann man auf Erdöllagerstätten schließen. Dieses Verfahren, lässt sich auch unter Wasser anwenden.
- Probebohrung: Nun wird durch eine Probebohrung festgestellt, ob dort Erdöl gelagert ist oder nicht.
- Erdölförderung: Man bohrt zwei Löcher bis zur Erdöllagerstätte. Durch das eine Bohrloch wird das Erdöl gefördert. Mithilfe des anderen Bohrlochs erhöht man den Druck in der Erdöllagerstätte, indem man z.B. Salzwasser hinein pumpt.
Erdöl als Waffe:
- Griechisches Feuer war ein Gemisch aus Erdöl und anderen brennbaren Flüssigkeiten, das mithilfe von Katapulten auf angreifende Schiffe geschleudert wurde.
- Im Mittelalter wurden brennendes Öl auf angreifende Feinde geschleudert.
- Im Golfkrieg wurde kuwaitisches Erdöl ins Meer geleitet, was den Angriff der Schiffe behinderte.
- Im Golfkrieg wurden Ölquellen angezündet, wodurch hohe wirtschaftliche und ökologische Schäden entstanden.
- Im Golfkrieg wurden Gräben ausgehoben, mit Erdöl befüllt und entzündet, was ein Vorrücken des Angreifers erschwerte.
- Im Golfkrieg verdunkelten die Abgase der brennenden Ölquellen den Himmel und erschwerte das Atmen sowie die Aufklärung durch Satelliten oder Flugzeuge.
- Erdöl wird als politisches Druckmittel verwendet, um die Ölmärkte zu beeinflussen.
Fragen zur Weiterverarbeitung von Erdöl:
- Nenne die wesentlichen Unterschiede bei der fraktionierten Destillation im Schulversuch und in der Erdölraffinerie.
- Wasser und Alkohol haben ganz bestimmte Siedetemperaturen. Bei den Fraktionen spricht man dagegen von Siedebereichen. Warum?
- Was wird bei der Erdöldestillation als Fraktion bezeichnet?
- Welche Fraktionen entstehen bei der Erdöldestillation, wofür werden sie verwendet?
- Benzin lässt sich leichter entzünden als Petroleum. Begründe.
- Welche Fraktionen sammeln sich am Boden eines Destillationsturms?
Fragen aus Cornelsen: Chemie Gesamtband-NRW, S. 158
2.2 Saurer Regen



Treibstoffe - Auto - Umwelt:
Welche Treibstoffe gibt es?
- Ethanol: Trinkalkohol (Brennspiritus), Abkürzung an der Tankstelle: E, in Brasilien weit verbreitet, wird aus pflanzlichen Rohstoffen gewonnen, z.B. Zuckerrohr
- LPG (Liquified-Petroleum-Gas = verflüssigtes Erdgas): unter Druck wird Erdgas verflüssigt, sodass man es recht problemlos tanken kann
- (Super-)Benzin: Gemisch aus Kohlenwasserstoffen (C6 bis C12), Siedebereich 80-130 °C, Oktanzahl: 95, E10-Super enthält 10% Ethanol
- Diesel: Gemisch aus Kohlenwasserstoffen (C15 bis C20), Siedebereich 200-350 °C, lässt sich nicht mit dem Feuerzeug entzünden, Cetanzahl: 100
- Kerosin: Flugzeugbenzin, Eigenschaften zwischen Benzin und Diesel, Siedebereich 175-280 °C, niedriger Schmelz-(Gefrier-)punkt
- Biodiesel: Rapsölmethylester (RME-Biodiesel) wird durch die Veresterung von z.B. Rapsöl mit Methanol gewonnen und hat ähnliche Eigenschaften wie Diesel
- Wasserstoff: bei der Verbrennung entsteht Wasserdampf, nicht verbreitet, kein Tankstellennetz, Energieerzeugung mithilfe von Verbrennung oder Brennstoffzellen, ungelöstes Tank-Problem, Erzeugung energieaufwändig, unbegrenzte Vorräte
- Erdgas: schwerer Tank im Kofferraum, Umbau wird von vielen Stadtwerken bezuschusst
- Spezialbenzine/-diesel (V-Power, Optimax, BP-Ultimate etc.): in der Regel erhöhte Oktanzahl, Zugabe von speziellen
Leistungssteigerern
, Hersteller verspricht höhere Leistung bzw. geringeren Verbrauch
Unterschiede Benzin - Diesel
| Benzin | Diesel |
| kurzkettige, stärker verzweigte Kohlenwasserstoffe C6-12 | langkettige Kohlenwasserstoffe C9-22 |
| enthält kein Öl | enthält Öl |
| Siedetemperatur 80-150 °C | Siedetemperatur 250-350 °C |
| lässt sich leicht entzünden | lässt sich nur nach Erhitzen oder feinem Zerstäuben entzünden |
| Schwerbenzin | Gasöle |
| hohe Mineralölsteuer 65,45 ct/l | niedrigere Mineralölsteuer 47,04 ct/l (Stand: 2007) |
| Benzin ein Gemisch aus Rohbenzin, Ethanol und Additiven | Gemisch aus Diesel und wenigen Additiven |
| Oktanzahl 95-100 | Oktanzahl: keine, stattdessen Cetanzahl 100 |
Funktionsweise eines 4-Takt-Motors
- Ansaugtakt: Das Gemisch aus Treibstoff und Luft wird angesaugt und vermischt. Der Kolben geht nach unten; durch das Einlassventil kommt das Gemisch in den Zylinder.
- Verdichtungstakt: Das Gemisch erhitzt sich beim Dieselmotor auf 500 °C-900 °C. Das Einlassventil schließt sich und es entsteht Druck; der Kolben geht nach oben.
- Arbeitstakt: Durch die Zündkerze entsteht ein Funke. Dieser entzündet das Gemisch und der Kolben bewegt sich schlagartig nach unten. Beim Dieselmotor entzündet sich das Gemisch durch die hohe Temperatur selbst.
- Auslasstakt: Die beim Arbeitstakt entstandenen Abgase werden durch das Auslassventil abgelassen. Der Kolben bewegt sich nach oben.
Abgase und deren Folgen
- Kohlenstoffdioxid CO2: Vermutlich mitverantwortlich für den Treibhauseffekt
- Kohlenstoffmonooxid CO: Giftiges Gas
- unverbrannte Kohlenwasserstoffe CnHm: Vermutlich mitverantwortlich für den Treibhauseffekt, teilweise giftig
- Stickoxide NOx: Verantwortlich für den Sauren Regen
- Schwefeldioxid SO2: Verantwortlich für den Sauren Regen
- Ruß (Feinstaub): Vermutlich Krebs erregend
Katalysator
- Kohlenstoffmonooxid CO: Reaktion mit Sauerstoff zu CO2
- unverbrannte Kohlenwasserstoffe CnHm: Reaktion mit Sauerstoff zu H2O und CO2
- Stickoxide NOx: Umwandlung zu N2 und O2
- Schwefeldioxid SO2: Sie dürfen nicht bei der Verbrennung von Benzin entstehen, da die Schwefeloxide den Katalysator zerstören würden. Daher wird in Ländern mit Katalysatorfahrzeugen ausschließlich entschwefeltes Benzin verwendet.
Rußpartikelfilter
Neue Dieselfahrzeuge enthalten einen Rußpartikelfilter. Über verschiedene technische Ansätze wird der Ruß aus den Abgasen entfernt. Dieses funktioniert nicht über eine katalytische Reaktion, sondern über einen Filter. Dieser Filter muss regelmäßig gereinigt werden, was bei den Rußpartikelfiltern automatisch durchgeführt wird.
Saurer Regen
- Ursachen
- Folgen
- Maßnahmen
2.3 Maßnahmen zur Energieeinsparung



Nutzung regenerativer Energien:
Windenergie
Vorteile:
- Windkraft ist preiswert
- geringer Platzverbrauch
- kein Ausstoß von Schadstoffen wie Stickoxide, Schwefeldioxid und Kohlenstoffdioxid
- Wind steht dauerhaft und kostenlos zur Verfügung
- keine Klimabeeinflussung
- Entlastung der fossilen Brennstoffe
- Unabhängigkeit von Rohstoffimporten
- Finanzieller Ertrag/Entschädigungen für Landwirte hoch
- Schaffung von Arbeitsplätzen in der Windkraftindustrie
Nachteile:
- Wind ist unregelmäßig vorhanden
- große Lärmbelastung
- hohe Installations- und Transportkosten
- hohe Instandhaltungs- und Wartungskosten
- Wind lässt sich nicht speichern und muss direkt in Strom umgewandelt werden
- Wind bläst meistens nachts, wenn wenig Strom benötigt wird
- nur geringe Strommengen (nicht effektiv)
- Errichtung eines neuen Stromnetzes
- Gefahr durch Unfälle (abreißende Flügelteile)
- optische Umweltverschmutzung
- Stilllegung der Windkraftanlage bei zu viel Wind
- Standortgebunden - Standortwahl muss geeignet sein
- Landwirte verlieren Nutzfläche
- Verlust von Arbeitskräften in klassischen Energiebereichen
- Gefahr für Vögel durch Rotorblätter
Solarenergie
Vorteile
- umweltfreundlich
- kann relativ wenig störend auf Dächer und andere Flächen platziert werden
- Sonne ist unbegrenzt vorhanden
- Fossile Brennstoffe werden entlastet
- keine Schadstoffe oder Lärm
- Schaffen von Arbeitsplätzen
- relativ wartungsfrei
- Sonneneinstrahlung ist gut zu berechnen (Kosten/Nutzen-Rechnung einfach)
- keine Gefahr von Umweltkatastrophen oder Unfällen
- gewonnener Strom kann auch von Privatleuten gewinnbringend verkauft werden
Nachteile
- Sonnenschein nur tagsüber
- hohe Materialkosten (Installationskosten)
- bei schlechtem Wetter kaum nutzbar
- wenig Strom wird produziert (Wirkungsgrad niedrig)
- zuviel gewonnener Strom lässt sich schlecht speichern
- Verschmutzung des Landschaftsbildes (bei großen Anlagen)
- Solarzellentechnologie steckt noch in ihren Anfängen
- Kosten werden erst nach Jahren wieder hereingeholt
Wasserkraft
Vorteile:
- kein Verbrauch fossiler Brennstoffe
- Wasserkraft ist ein unerschöpflicher Energieträger
- kontinuierliche/wetterunabhängige Energieproduktion
- keine (Luft-)Schadstoffe
- Staudämme fördern den Hochwasserschutz
- lange Laufzeit
- an vielen Orten der Welt können Gezeitenkraftwerke installiert werden
- Schaffung sicherer Arbeitsplätze
- hoher Wirkungsgrad
- keine Erwärmung des Wassers wie bei Kohlekraftwerken
- Energieausbeute lässt sich gut regeln
- Verbesserung der Schiffbarkeit von Flüssen
- kontinuierliche Stromerzeugung durch (Pump-)Speicherkraftwerke
Nachteile:
- starker Eingriff in die Natur, Zerstörung von Fischgründen
- Schwallbetrieb
- lange Bauzeit
- Standortgebunden
- Beeinflussung der Küstenlandschaft und Meeresbiologie bei Gezeitenkraftwerken
- bei großen Stauseen Umsiedlungen von Menschen erforderlich
- Änderung des Grundwasserhorizonts
- Auslösen von Erdbeben
- sehr teuer
- ehemaliges Schwemmland wird unfruchtbar durch fehlenden Schlamm-Eintrag
- Wartungsaufwand hoch
- Überstauung und Zerstörung von Kulturgütern
3 Chemische Verwandschaften



Die Schüler sollen
- die Stoffgruppen Alkalimetalle, Erdalkalimetalle, Halogene und Edelgase als Stoffgruppen mit untereinander ähnlichen Eigenschaften klassifizieren
- für die Stoffgruppe typische Eigenschaften angeben
Klasse 9
1 Erforschung des Atombaus



Die Schüler sollen
- verschiedene Atommodelle (DALTON, RUTHERFORD, BOHR) vergleichen
- den Aufbau von Atomen anhand des Kern-Hülle-Modells (RUTHERFORD) beschreiben
- die elektrische Leitfähigkeit anhand dieses Modells erklären
- Bestandteile des Atoms (Elektron, Proton, Neutron) angeben
- Ausführen, dass das Periodensystem der Elemente nach steigender Protonenzahl und Bau der Elektronenhülle geordnet ist
Aufbau von Atomen
| Elektronen | Protonen | Neutronen | |
| Symbol | e− | p(+) | n |
| Masse | ca. 2000 mal leichter als Proton (0,00055 u) | ca. 1 u (1,00728 u) | ca. 1 u (1,00867 u) |
| Aufenthaltsort | in der Atomhülle in bestimmten Schalenum den Atomkern |
im Atomkern | im Atomkern |
| Beweglichkeit | frei beweglich | nicht beweglich | nicht beweglich |
| Ladung | negative Elementarladung | positive Elementarladung | elektrisch neutral |
| Aufgabe im Atom | Die Zahl der Elektronen in der äußersten Schale bestimmt die Eigenschaften des Atoms | Die Anzahl der Protonen legt fest, um welches Element es sich handelt | Die Neutronen halten die Protonen im Atomkern wie Klebstoffzusammen |
| Entdecker | Joseph John Thomson | Ernest Rutherford | James Chadwick |
| Entdeckungsjahr | 1897 | 1919 | 1932 |
1.1 Elektrische Leitfähigkeit



Ein Stoff ist immer dann elektrisch leitfähig, wenn er in der Lage ist, Elektronen von einem Ort zum anderen zu transportieren. In der Chemie spielen zwei Arten der Leitfähigkeit eine entscheidende Rolle:
Metalle
Metalle können Elektronen transportieren, da ihr Atombau sie dazu geradezu prädestiniert. Zwischen den positiv geladenen Atomrümpfen der Metallatome in einem Stück Metall befinden sich frei bewegliche Elektronen. Werden jetzt zusätzliche Elektronen in das Stück Metall geleitet, so verlassen im gleichen Moment andere Elektronen des Stück Metall - es sei denn, es gibt keinen geschlossenen Stromkreislauf. Können die Elektronen das Metallstück nicht verlassen, so kommt es zu einem Kurzschluss und das Metall glüht hell auf.
Bsp.: Kupferkabel
Ionen
Ionen sind geladene Atome. So gibt es positiv geladene Atome (Kationen), denen Elektronen in ihrer Elektronenhülle fehlen. Außerdem gibt es negativ geladene Atome (Anionen), die einen Überschuss an Elektronen in ihrer Elektronenhülle besitzen. Dadurch sind sie in der Lage, Elektronen von einem Ort zum anderen zu transortieren.
Bsp.: Salzwasser
1.2 Atommodell nach Rutherford



Wie sah der Streuversuch aus?
- Man hat einen Bleiblock mit runder Öffnung hergestellt. Man hat Uran hineingefüllt. Die positiv geladene radioaktive Strahlung (alpha-Teilchen) wird durch eine Öffnung in der Lochblende gerichtet und trifft auf die Goldfolie. Er hat eine Fotoplatte aufgestellt um die Strahlen zu sehen. Dieser Schirm umgibt die Goldfolie wie eine runde Mauer.
- Die meisten radioaktiven Teilchen durchdringen die Goldfolie ohne abgelenkt zu werden. Nur sehr wenige alpha-Teilchen wurden abgelenkt. Sie müssen auf einen massiven Gegenstand mit hoher Masse getroffen sein. Wurden die alpha-Teilchen reflektiert, so trafen sie den Bereich des Atoms mit der hohen Masse frontal, wurden die alpha-Teilchen nur abgelenkt, so streiften die alpha-Teilchen den Masse-Bereich. RUTHERFORD nannte diesen Bereich Atomkern.
- Um die Atomkerne herum muss es einen leeren Bereich geben, der die alpha-Teilchen nicht ablenkt. Er nannte diesen Leerraum Atomhülle.
Welche Erkenntnisse schloss RUTHERFORD daraus?
- Atome sind keine festen Kugeln und sie lassen alpha-Strahlen durch.
- Der Atomkern lässt keine alpha-Strahlung durch.
- Die Masse des Atoms konzentriert sich auf einen kleinen Raum.
- Der Raum zwischen dem Atomkern und der Atomhülle ist leer.
Wie stellt sich RUTHERFORD den Aufbau der Atome vor?
Die Atome haben einen Atomkern und eine Atomhülle. Die Atomkerne sind positiv geladen. Protonen und Neutronen bilden den Atomkern. Der Rest des Atoms enthält die negativen Bausteine, die Elektronen. 99,9% der Atommasse ist im Atomkern konzentriert. Das ganze Atom ist 100000mal so groß wie der Atomkern.
1.3 Das Periodensystem der Elemente



Die Schülerinnen und Schüler sollen
- den Zusammenhang zwischen Elementfamilie und Stellung im Periodensystem beschreiben,
- Steckbriefe zu den einzelnen Elementen erstellen und ein eigenes Periodensystem zusammensetzen können,
- sich Merksätze zu den Elementfamilien ausdenken und merken können,
- die Elemente der Hauptgruppen in der richtigen Reihenfolge nennen können.
- die Anzahl der Protonen und Neutronen anhand der Ordnungszahl und der Atommasse ableiten können
- den Begriff der Isotope nennen und die Bedeutung erklären können
Bestimmung der Anzahl der Kernteilchen (Protonen und Neutronen) anhand der Ordnungszahl und der Atommasse
- Kohlenstoff (OZ: 6, Atommasse: 12 u): Aus der OZ 6 ergibt sich eine Anzahl von 6 Protonen, die zusammen eine Masse von 6 u haben. Es fehlen an der Gesamtmasse von 12 u des Kohlenstoffs noch 6 u, die von den Neutronen geliefert werden. Es müssen also 6 Neutronen im Kern vorhanden sein: 6 u (6 Protonen) + 6 u (6 Neutronen) = 12 u (Gesamtmasse Kohlenstoff)
- Fluor (OZ: 9, Atommasse: 19 u): Aus der OZ 9 ergibt sich eine Anzahl von 9 Protonen, die zusammen eine Masse von 9 u haben. Es fehlen an der Gesamtmasse von 19 u des Fluors noch 10 u, die von den Neutronen geliefert werden. Es müssen also 10 Neutronen im Kern vorhanden sein: 9 u (9 Protonen) + 10 u (10 Neutronen) = 19 u (Gesamtmasse Fluor)
- Chlor (OZ: 17, Atommasse: 35,453 u): Aus der OZ 17 ergibt sich eine Anzahl von 17 Protonen, die zusammen eine Masse von 17 u haben. Es fehlen an der Gesamtmasse von 35,453 u des Chlors noch 18,453 u, die von den Neutronen geliefert werden. Es müssen also 18,453 Neutronen im Kern vorhanden sein - leider gibt es aber keine
halben
Neutronen! Wie kann dieses Problem gelöst werden? Lösung: Isotope!
Isotope
Im Periodensystem findet man viele Elemente mit einer ungeraden Atommasse (z.B. Chlor). Wie kann das sein, da es keine halben Elementarteilchen gibt? Die Lösung liegt in der Existenz von Isotopen
. Es gibt - um beim Beispiel Chlor zu bleiben - Chlor-Atome mit 18 Neutronen und Chlor-Atome mit 20 Neutronen. Chlor mit 18 Neutronen hat eine Atommasse von 35 u (17 Protonen + 18 Neutronen). Es wird mit 35Cl bezeichnet - gesprochen Chlor 35
. 37Cl ist analog das Chlor-Atom mit 20 Neutronen und 17 Protonen. Wie man sieht, bleibt die Zahl der Protonen gleich - es handelt sich schließlich um Chlor-Atome, die immer 17 Protonen besitzen.
- 35Cl: Chlor 35 kommt in der Natur zu ca. 75% vor. In einer normalen Gasflasche mit Chlor-Gas enthalten also 75% aller Chlor-Atome 18 Neutronen.
- 37Cl: Chlor 37 finden wir mit einem Anteil von ca. 25% in der Natur.
Beide Chlor-Isotope unterscheiden sich nur in ihrer Masse, nicht jedoch in ihren Eigenschaften, da sie 17 Elektronen mit 7 Elektronen auf der Außenschale aufweisen. Aus der Kombination von 75% mal 35 u und 25% mal 37 u ergibt sich die krumme
Gesamtmasse von 35,453 u (0,75 · 35 + 0,25 · 37 ≈ 35,453). Die Werte 75% und 25% sind gerundet, daher ist die Rechnung ungenau).
2 Chemische Bindung



Die Schüler sollen
- anhand des Schalenmodells (BOHR) die Bindungsarten erklären
- das Verhalten verschiedener Stoffe mit Hilfe der Bindungsarten begründen
2.3 polarisierte Atombindung



Die Schülerinnen und Schüler sollen
- Wasser als ein Beispiel für eine polarisierte Atombindung benennen können,
- das Molekülmodell von Wasser und die polarisierte Atombindungen einzeichnen können,
- den Dipol-Charakter des Wassers mithilfe der polarisierten Atombindung erklären können,
- erklären können, warum einige Stoffe wasserlöslich sind und andere nicht (z.B. Salze, Fett, etc.),
- den Merksatz
Gleiches löst sich in Gleichem
erklären können, - mithilfe des Begriffes der
Elektronegativität
weitere polare Moleküle zeichnen können.
3 Säuren, Laugen, Salze



Die Schüler sollen
- Säuren und Laugen mithilfe verschiedener Indikatoren nachweisen
- Säuren als Stoffe definieren, die in wässrigen Lösungen Wasserstoffionen abgeben
- Laugen als wässrige Lösungen definieren, die Hydroxidionen enthalten
- aufführen, dass der pH-Wert angibt, wie sauer oder alkalisch eine Lösung ist
- die Neutralisation als Reaktion beschreiben, bei der die Wirkung saurer und alkalischer Lösungen durch Reaktion von Wasserstoff- mit Hydroxidionen aufgehoben wird
- die verschiedenen Reaktionsmechanismen der Salzbildung beschreiben
3.1 Bildung, Eigenschaften und Verwendung gebräuchlicher Säuren



Nachweis von Säuren
- mit Rotkohl
- mit Universalindikator
Herstellung von Kohlensäure, Schwefeliger Säure, Phosphoriger Säure
Eigenschaften von allen Säuren
- Säuren geben in wässriger Lösung Wasserstoff-Protonen ab
- pH-Wert ist kleiner als 7
- verfärben den Universal-Indikator rot-gelb
- alle Säuren reagieren mit unedlen Metallen, dabei entsteht Wasserstoff-Gas
- alle Säuren reagieren mit Kalkstein, dabei entsteht Kohlenstoffdioxid
- alle Säuren leiten den elektrischen Strom
Chemischer Aufbau von anorganischen Säuren
Anorganische Säuren entstehen, wenn
a) Nichtmetalloxid + Wasser ⇋ Säure
Schwefeltrioxid + Wasser ⇋ Schwefelsäure
SO3 + H2O ⇋ H2SO4
b) Halogen + Wasserstoff ⇋ Säure
Chlor + Wasserstoff ⇋ Salzsäure
Cl2 + H2 ⇋ 2 HCl
Alle Säuren enthalten Wasserstoff-Teilchen. Sobald die Säuren in Kontakt mit Wasser kommen, lösen sich die Wasserstoff-Teilchen vom sogenannten Säurerest. Sobald dieses passiert, entstehen Hydronium-Ionen (Säureteilchen), H3O+-Ionen.
Verwendung von Säuren
3.2 Wichtige Laugen



Herstellung:
Laugen lassen sich auf drei Wegen herstellen:
- unedles Metall + Wasser
- Metalloxid + Wasser
- Metallhydroxid + Wasser
Beispiele:
- Lithium + Wasser
- Magnesiumoxid + Wasser
- Natriumhydroxid + Wasser
Eigenschaften:
Alle Laugen haben folgende Eigenschaften:
- Laugen sind flüssig
- Laugen leiten den elektrischen Strom
- Laugen fühlen sich seifig an
- Laugen färben den Universalindikator blau-violett
- Laugen haben einen pH-Wert von über 7
- Laugen neutralisieren Säuren
Wichtige Laugen:
- Natronlauge NaOH
- Kalilauge KOH
- Lithiumlauge: LiOH
3.3 Der pH-Wert



Der pH-Wert:
- Maßeinheit, um den
Säuregehalt
einer Lösung zu bestimmen Gefährlichkeit
der Säure- pH 7: neutral
- pH 0-7: sauer
- pH 7-14: alkalisch
- zeigt an, wie viele Wasserstoffprotonen (H+) in der Lösung enthalten sind
- je saurer die Lösung, desto kleiner der pH-Wert
- bei einem pH-Wert über 7 spricht man von Laugen
- Farbskala beim Universalindikator
Der pH-Wert ist der negativ dekadische Logarithmus der H3O+-Ionen-Konzentration.
Beispiel: In einer wässrigen Lösung misst man eine H3O+-Konzentration von einem Wasserstoff-Proton auf 1.000 andere Teilchen. Die H3O+-Konzentration ist also 1:1.000 (Eins zu Tausend). 1:1.000 lässt sich schreiben als 1:103. Wendet man Potenzgesetze an, so lässt sich 1:103 schreiben als 10-3. Der Exponent wird mithilfe der Logarithmus-Funktion zur Basis 10 ermittelt. Bei 10-3 ist der Exponent gleich -3. Da man den negativen Logarithmus berechnet, wird aus der negativen -3 die positive +3. Dieser Wert +3 ist der pH-Wert.
Bei einem pH-Wert von 6 hat man also folgende Konzentration: 10-6 = 1:1.000.000. Auf eine Million Teilchen kommt ein Säure-Teilchen H3O+.
3.4 Die Neutralisation



Bei der Neutralisation reagieren Säuren und Laugen miteinander. Die Säure-Teilchen (H3O+) reagieren mit den Lauge-Teilchen (OH-). Es bildet sich Wasser (H2O).
Eine Lösung ist neutral, wenn sich gleich viele H3O+-Teilchen wie OH--Teilchen in der Lösung befinden.
4 Chemie und Boden



- chemische Prozesse im Boden beschreiben
- die Bedeutung von (Mineral-)Dünger erfassen
- wichtige Stoffkreisläufe darstellen
4.1 Salpeter- und Phosphorsäure



Salpetersäure (HNO3)
Salpetros (lat.: Salz aus dem Felsen) - Apatit war bei der Entdeckung der Salpetersäure das Mineral, woraus die Salpetersäure gewonnen wurde.
Einsatz |
Eigenschaften |
Herstellung |
|
|
|
Phosphorsäure (H3PO4)
Phosphorsäure entsteht bei der Reaktion von oxidiertem Phosphor mit Wasser.
Einsatz |
Eigenschaften |
Herstellung |
|
|
|
4.2 Düngemittel



Alle Pflanzen benötigen Nährstoffe:
- viel: Magnesium (Mg), Calcium (Ca), Phosphor (P), Kalium (K), Stickstoff (N)
- wenig: Schwefel (S), Eisen (Fe), Zink (Zn), Chlor (Cl), Mangan (Mn), Bor (B), Molybdän (Mo), Kupfer (Cu)
Neben diesen Nährstoffen aus dem Boden brauchen alle Pflanzen zum Wachsen:
- Wasser
- Licht/Wärme
- Kohlenstoffdioxid (CO2)
Justus von Liebig erkannte 1840 als erster das Gesetz vom Wachstumsminimum. Der Nährstoff, der am wenigsten vorhanden ist, beschränkt das Wachstum der Pflanze. Es bringt daher keinen Ertrag, einen anderen Nährstoff zu düngen, der in ausreichender Menge vorhanden ist. Es muss der Nährstoff durch Düngung ersetzt werden, der fehlt. Um von allen Nährstoffen genügend Vorräte im Boden zu erhalten, nutzt man folgende Methoden:
- der Pflanzenanbau wird regelmäßig gewechselt, um den Boden Zeit zu geben, sich zu regenerieren (Wechsel zwischen den Feldfrüchten und Brachzeiten)
- Bodenproben nehmen, fehlende Nährstoffe ermitteln, auf diese fehlenden Nährstoffe abgestimmten Dünger verwenden
Herstellung von Kunstdünger
4.3 Auswirkungen auf die Umwelt (Eutrophierung)



5 Werk- und Baustoffe



5.1 Der technische Kalkkreislauf



5.2 Zement, Beton



5.3 Aufbau und Verwendung verschiedener Glassorten



6 Elektrochemie



Die Schüler sollen
- Elektronenströme innerhalb einer elektrischen Zelle begründen
- eine Fällungsreihe der Metalle erstellen und diskutieren
- galvanische Elemente beschreiben und erklären
- den Vorgang der Korrosion bei verschieden edlen Metallen beschreiben
- angeben, wie der Galvanisierung- und Eloxierungsvorgang funktioniert und wo sie in der Technik eingesetzt werden
6.1 Batterie – Akkumulator



Batterie:
Jede Batterie besteht aus drei grundsätzlichen Bauteilen: Dem Minuspol, dem Pluspol und einem Elektrolyten.
| Minuspol | Pluspol | Elektrolyt | |
| Aufbau | Der Minuspol besteht immer aus einem unedlen Metall | Der Pluspol besteht aus einem edleren Metall oder dem dazugehörigen Metalloxid | Das Elektrolyt ist meistens eine Flüssigkeit, die in der Lage ist, Metallionen aufzunehmen. |
| Beispiel | Zink | Mangandioxid | Kalilauge |
| Funktionsweise | Die Zinkatome werden zu Zinkionen. Dabei gehen die Ionen in den Elektrolyten und die frei werdenden Elektronen wandern durch den Verbraucher zum Pluspol. | Das Mangan im Mangandioxid nimmt die ankommenden Elektronen auf. Aus dem Mn4+ wird durch Aufnahme der Elektronen Mn2+ | Die Kalilauge nimmt die frei werdenden Zinkionen (Zn2+) auf. |
Akkumulator:
Ladevorgang:
| Minuspol | Pluspol | Elektrolyt | |
| Aufbau | Der Minuspol besteht wie bei einer normalen Batterie aus einem unedlen Metall. | Wie bei der Batterie können durch ein Metalloxid bzw. -hydroxid Elektronen aufgenommen werden. | Der Elektrolyt kann die am Minuspol frei werdenden Metallionen aufnehmen. Er enthält bei Lithium-Akkus kein Wasser. |
| Beispiel | Cadmium | Nickeloxid-hydroxid | Kalilauge |
| Funktionsweise | Anders wie bei einer Batterie ist ein Akku aus vielen kleinen Zellen aufgebaut, in denen das Metall am Minuspol in den nur dort vorhandenen Elektrolyten wandern können. Beim Ladevorgang wandern die Ionen aus dem Elektrolyten zurück an den Minuspol. Durch ein Ladegerät erhalten die Metallionen Elektronen zurück und werden wieder zum elementaren Metall. | Das Ladegerät entzieht dem Nickeloxid-hydroxid die aufgenommenen Elektronen. Dadurch kann beim nächsten Entladevorgang der Pluspol wieder viele Elektronen aufnehmen. | Die Kalilauge gibt die Cadmiumionen an den Minuspol ab. |
Nickel-Cadmium-Akkus sind heute in Deutschland verboten.
Entladevorgang:
| Minuspol | Pluspol | Elektrolyt | |
| Aufbau | Der Minuspol besteht wie bei einer normalen Batterie aus einem unedlen Metall. | Wie bei der Batterie können durch ein Metalloxid bzw. -hydroxid Elektronen aufgenommen werden. | Der Elektrolyt kann die am Minuspol frei werdenden Metallionen aufnehmen. Er enthält bei Lithium-Akkus kein Wasser. |
| Beispiel | Cadmium | Nickeloxid-hydroxid | Kalilauge |
| Funktionsweise | Cadmiumionen wandern in den Elektrolyten, Elektronen bleiben zurück und laden den Minuspol negativ auf. | Die frei gewordenen Elektronen werden vom Nickeloxid-hydroxid aufgenommen. | Die Kalilauge nimmt die frei werdenden Cadmiumionen (Cd2+) auf. |
6.2 Aluminum



6.3 Korrosion



Was ist Korrosion?
Durch den Einfluss von Luft, Wasser oder agressiven Stoffen (z.B. Streusalz) werden viele Metalle im Laufe der Zeit zerstört.
Reaktion mit Sauerstoff: Die Metallatome reagieren entweder mit der Luft zu Metalloxiden, die ganz andere Eigenschaften als das ursprüngliche Metall haben (z.B. rauhe Oberfläche, geringere/höhere Dichte, Wasserlöslichkeit usw...)
Reaktion mit (Salz-)Wasser: Die Metallatome wandern als Metallionen in das (Salz-)Wasser. Sie fehlen nun im Metallstück, wodurch Löcher entstehen und die Oberfläche zerstört wird.
Warum werden Autokarosserien mit einer dünnen Zinkschicht überzogen?
6.4 Galvanisieren – Eloxieren



Wie kann man einen Wasserhahn verchromen?
Experiment: Verkupfern eines Metallgegenstandes
Klasse 10
Organische Chemie
1 Kohlenwasserstoffe



Was ist eigentlich eine organische Substanz?
Nachweis von organischen Substanzen
Die Schüler sollen
- die Nomenklatur in der organischen Chemie beherrschen
- die Alkane als wichtigste Chemikalien in der Kunststoffchemie und Energiewirtschaft nennen
- Eigenschaften und Aufbau der Alkane herleiten
- den Vorgang in einer Raffinerie erklären
- begründen, warum die ungebremste Verbrennung von Kohlenwasserstoffen eine der größten Gefahren für die Erde ist
- Alkane, Alkene und Alkine vergleichen
- Additions- und Substitutionsreaktion beschreiben
- die Gefährdung des Menschen durch die Verwendung von FCKWs begründen
1.1 Alkane



Die homologe Reihe der Alkane umfasst alle organischen Verbindungen aus Kohlenstoff (C) und Wasserstoff (H), auch Kohlenwasserstoffe (KW) genannt, deren Kohlenstoffatome im Molekül in einer Reihe angeordnet sind. Es dürfen keine Doppel- oder Dreifachbindungen zwischen den Kohlenstoffatomen vorhanden sein, d.h., Alkane sind gesättigte Kohlenwasserstoffe
. Alle flüssigen Alkane sind gute Lösungsmittel für Fette, Öle und Wachse. Die Summenformel der Alkane lautet CnH2n+2.
1. Methan CH4
Physikalische Eigenschaften: Methan schmilzt bei −182,6 °C und siedet bei −161,7 °C. Aufgrund der unpolaren Eigenschaften ist es in Wasser kaum löslich, in Ethanol und Diethylether löst es sich jedoch gut. Schmelzwärme und Verdampfungswärme sind mit 1,1 kJ/mol und 8,17 kJ/mol für ein Gas relativ hoch, im Vergleich zu Metallen sind dies aber sehr geringe Werte. Der Heizwert Hi liegt bei 35,89 MJ·m-3. Die Standardentropie beträgt 188 J/mol·K, die Wärmekapazität 35,69 J/mol·K. Bei 90,67 K und 0,117 bar weist Methan einen Tripelpunkt auf, bei 190,56 K und 45,96 bar einen kritischen Punkt. Das farb- und geruchlose Gas hat eine geringere Dichte als Luft, es steigt also in die höheren Schichten der Erdatmosphäre auf. Dort wirkt es als Treibhausgas, wobei es 20- bis 30-mal wirkungsvoller ist als Kohlenstoffdioxid, allerdings kommt es in viel geringeren Mengen als dieses in der Atmosphäre vor. Es reagiert dort mit Sauerstoff zu Kohlenstoffdioxid und Wasser. Dieser Prozess ist allerdings langsam, die Halbwertszeit wird auf 14 Jahre geschätzt. Die UN-Nummern von verdichtetem und tiefgekühltem Methan sind 1971 bzw. 1972.
Chemische Eigenschaften: Methan ist das einfachste Alkan und der einfachste Kohlenwasserstoff, die Summenformel lautet CH4, die C–H-Bindungen weisen in die Ecken eines Tetraeders. Es ist brennbar und verbrennt an der Luft mit bläulicher, nicht rußender Flamme. Es kann explosionsartig mit Sauerstoff oder Chlor reagieren, wozu allerdings eine Initialzündung (Zufuhr von Aktivierungsenergie) oder Katalyse erforderlich ist. Bei der Chlorierung entstehen Chlormethan, Dichlormethan, Chloroform und Tetrachlormethan. Bei der Oxidation dagegen wird das Molekül komplett auseinandergerissen. Aus der Reaktion eines Methanmoleküls mit zwei Sauerstoffmolekülen entstehen zwei Wasser- und ein Kohlenstoffdioxidmolekül. Vom Methan leiten sich Methylverbindungen wie z. B. Methanol und die Methylhalogenide sowie die längerkettigen Alkane ab.
2. Ethan C2H6
Ethan (früher: Äthan) ist eine chemische Verbindung, die den Alkanen zugehört (gesättigte Kohlenwasserstoffe). Ethan ist ein farbloses und geruchloses Gas, es schmilzt bei −182,76 °C und siedet bei −88,6 °C. Es ist nur schlecht in Wasser löslich: 61 mg/l bei 20 °C. Zum Schmelzen werden 583 J/mol benötigt, zum Sieden 10 kJ/mol. Es wird vor allem zu Heiz- und Verbrennungszwecken genutzt. Von Ethan abgeleitet ist der Ethyl-Rest (C2H5−). Ethan ist neben Methan ein Hauptbestandteil des Erdgases.
Propan C3H8
Propan ist ein farb- und geruchloses Gas, hat einen Schmelzpunkt von −187,7 °C und einen Siedepunkt von −42 °C. Die kritische Temperatur liegt bei 96,8 °C, der kritische Druck bei 4,2 MPa und die kritische Dichte bei 0,22 g·cm-3. Propan ist ein farb- und geruchloses Gas, hat einen Schmelzpunkt von −187,7 °C und einen Siedepunkt von −42 °C. Die kritische Temperatur liegt bei 96,8 °C, der kritische Druck bei 4,2 MPa und die kritische Dichte bei 0,22 g·cm-3. Propan kann leicht verflüssigt werden. Es löst sich bei 20 °C zu 75 mg·l−1 in Wasser. Propan ist schwerer als Luft und wirkt in hohen Konzentrationen narkotisierend bis erstickend. Propan ist hochentzündlich und bildet zwischen einem Volumenanteil von 2,12 % bis 9,35 % in Luft explosible Gemische. Seine Zündtemperatur liegt bei 470 °C (nach DIN 51794). Der Heizwert beträgt 93 MJ·m−3.
Butan C4H10
Butan ist ein gasförmiges farbloses Alkan, das in Form der beiden Strukturisomeren n-Butan CH3–CH2–CH2–CH3 und Isobutan CH(CH3)3 (IUPAC-Name: Methylpropan) vorkommt. Eigenschaften von n-Butan (IUPAC-Name: Butan): Butan ist bei Raumtemperatur (abhängig vom Druck) gewöhnlich gasförmig und hat einen Schmelzpunkt von −138 °C und einen Siedepunkt von −0,5 °C. In Wasser ist Butan nahezu unlöslich (90 mg/l). n-Butan ist brennbar, Bromwasser und Kaliumpermanganatlösung werden durch n-Butan nicht entfärbt. Mit den Halogenen Chlor und Brom reagiert n-Butan – wie andere Alkane auch – gewöhnlich nicht. Unter Lichteinfluss bildet sich jedoch photochemisch durch eine Radikalkettenreaktion ein Gemisch verschiedener Chlorbutane bzw. Brombutane. Der Explosionsbereich von n-Butan liegt in Luft zwischen der unteren Explosionsgrenze (UEG) von 1,4 Vol.-% (33 g·m–3) und der oberen Explosionsgrenze (OEG) von 9,4 Vol.-% (231 g·m–3). Butan ist ein sogenanntes Flüssiggas.
Pentan C5H12
Pentane sind Kohlenwasserstoffe mit der Summenformel C5H12 und zählen zu den Alkanen. Es existieren drei Konstitutionsisomere: n-Pentan, Isopentan und Neopentan.
Hexan C6H14
Die Hexane sind eine Gruppe von aliphatischen, gesättigten Kohlenwasserstoffen bzw. Alkanen, die alle sechs Kohlenstoffatome im Molekül enthalten. Die Summenformel der Verbindungen ist C6H14. Es existieren fünf Isomere:
- n-Hexan
- 2-Methylpentan
- 3-Methylpentan
- 2,2-Dimethylbutan
- 2,3-Dimethylbutan
Neben dem n-Hexan können zwei Methylpentane und zwei Dimethylbutane formuliert werden. Bei allen Verbindungen handelt es sich um leichtflüchtige Flüssigkeiten mit relativ ähnlichen Eigenschaften. Aus der Verzweigung der Kohlenstoffkette resultiert ein teilweise signifikantes Absinken der Schmelzpunkte. Die Siedepunkte verringern sich weniger stark. Entsprechend verhalten sich die Dampfdruckwerte bei niedrigeren Temperaturen.
Heptan C7H16
Oktan C8H18
Nonan C9H20
Dekan C10H22
Isomerie der Alkane
Durch die besondere Struktur des Kohlenstoff-Atoms kommt es ab Butan zu sogenannten Isomeren. Isomere Kohlenwasserstoffe haben die gleiche Summenformel wie die Alkane, aber eine andere Struktur. Das einfachste Isomer des Butans wird iso-Butan genannt. Im Gegensatz zum n-Butan sind die Kohlenstoff-Atome nicht in einer Kette hintereinander angeordnet (deshalb wird n-Butan so abgekürzt: das n steht für n C-Atome, die in einer Reihe mit n Atomen angeordnet sind), sondern iso-Butan besitzt eine Seitenkette mit einem C-Atom.
n-Butan: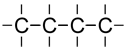 C4H10
C4H10
iso-Butan: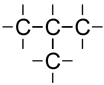 C4H10
C4H10
Korrekte Bezeichnung für Isomere
Die längste C-Kette im iso-Butan ist drei C-Atome lang (3 C-Atome = Propan). Dabei ist es unerheblich, ob die C-Atome auf einer Linie liegen oder abgeknickt sind. Am zweiten C-Atom dieser längsten Kette zweigt ein C-Atom ab. Abzeigungen mit einem C-Atom werden Methyl genannt (nach Methan, das auch genau ein C-Atom enthält). iso-Butan wird demzufolge 2-Methyl-propan genannt.
Diese Logik wird für alle Isomere verwendet:
- Die längste C-Kette (egal, ab gewinkelt oder nicht) wird gesucht und benennt das Isomer (siehe oben: -propan)
- Diese längste Kette wird so durchnummeriert, dass die Abzweigungen bei möglichst kleinen Zahlen auftauchen (dadurch entscheidet sich, ob man von links oder von rechts durchnummeriert)
- Im vorletzten Schritt geht man alle Abzweigungen durch und schreibt sie auf. Je nachdem, wie viele C-Atome eine Abzweigung hat, wird sie Methyl (ein C-Atom), Ethyl (zwei C-Atome), Propyl (drei C-Atome) usw. genannt (siehe oben: -Methyl-). Enthält ein Isomer mehr als eine gleiche Abzweigung (z.B. zwei Methyl-Abzweigungen), so stellt man die Anzahl der gleichen Abzweigungen dem Namen der Abzweigung voran: zweimal Methyl = Dimethyl, dreimal Methyl = Trimethyl, viermal Methyl = Teramethyl usw.)
- Vor den Namen der Abzweigung (z.B. Methyl) werden die Zahlen gestellt, an welcher Stelle in der längsten C-Atom-Kette diese Abzweigungen zu finden sind (siehe oben: 2-Methyl, am 2. C-Atom sitzt die Methyl-Abzweigung)
Beispiel 2:
iso-Undecan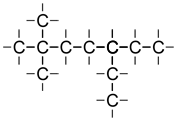 C11H24
C11H24
- Die längste Kette ist 7 C-Atome lang. Also wird dieses iso-Undecan (es gibt noch weitere Isomere des Undecans) auch als -heptan bezeichnet.
- Die längste Kette wird durchnummeriert - in diesem Fall von links nach rechts:
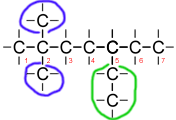
- Folgende Abzweigungen sind zu erkennen: zweimal Methyl, einmal Ethyl. Zweimal Methyl wird mit Dimethyl bezeichnet. Da das Ethyl nur einmal vorkommt, bleibt es beim Ethyl.
- Am 2. C-Atom hängen beide Methyl-Abzweigungen. Am 5. C-Atom hängt die Ethyl-Abzweigung. Somit muss dieses Isomer des Undecans folgendermaßen heißen: 2,2-Dimethyl-5-Ethyl-heptan
1.2 ungesättigte Kohlenwasserstoffe: Alkene und Alkine



Alkene
Alkene sind ungesättigte Kohlenwasserstoffe mit einer C=C-Doppelbindung. Ungesättigt bedeutet, dass dem Molekül im Vergleich zum entsprechenden Alkan Wasserstoffatome fehlen. Ursache ist mindestens eine Doppelbindung. Das einfachste Alken heißt Ethen und hat die Summenformel C2H4. Die allgemeine Summenformel für Alkene lautet CnH2n. Alle Alkene reagieren mit Halogenen. Dabei werden die C=C-Doppelbindungen aufgebrochen und die Halogene lagern sich entsprechend an. Alle kurzkettigen Alkene sind hochentzündlich.
1. Methen
Das Alken Methen
existiert nicht, da ein einzelnes Kohlenstoffatom keine Doppelbindungen (z.B. mit sich selbst) eingehen kann.
2. Ethen
Ethen (auch: Ethylen) ist ein ungesättigter Kohlenwasserstoff mit einer C=C-Doppelbindung. Die Summenformel ist C2H4, die Strukturformel H2C=CH2. Der Schmelzpunkt liegt bei −169 °C, der Siedepunkt bei −104 °C. Ethen reagiert mit Brom, dabei entsteht 1,2-Dibromethan. Ethen fördert die Obstreife, reife Früchte dünsten Ethen aus. Die Doppelbindung bricht leicht auf. Polyethylen (PE) wird aus vielen Ethen-Molekülen hergestellt. Ethen hat einen süßlichen Geruch. Es ist gut brennbar.
3. Propen
Propen (auch: Propylen) hat die Summenformel C3H6, enthält also eine C=C-Doppelbindung. Die Strukturformel ist H2C=CH−CH3. Aus Propen wird mithilfe einer Polyadditionsreaktion der Kunststoff Polypropylen (PP) hergestellt. Propen schmilzt bei ca. −185 °C und siedet bei ca. −47 °C. Propen wirkt narkotisierend.
4. Buten
Buten wird auch n-Buten genannt. Die Strukturformel ist H2C=CH−CH2−CH3. Schmelztemperatur: −185 °C. Siedetemperatur: −6 °C. Es ist ein farbloses Gas, das sich nicht in Wasser löst. Buten ist ein Bestandteil vieler Kunststoffe. Ähnlich wie Butan und Propan lässt es sich leicht verflüssigen.
5. Penten
Penten hat die Formel C5H10. Schmelztemperatur: −138 °C. Siedetemperatur: 30 °C. Bei Zimmertemperatur ist Penten eine farblose Flüssigkeit. Penten wird auch Amylen genannt. Man findet Penten in großen Mengen im Steinkohlenteer.
Alkine
Alkine sind ungesättigte Kohlenwasserstoffe mit einer C≡C-Dreifachbindung. Ungesättigt bedeutet, dass dem Molekül im Vergleich zum entsprechenden Alkan Wasserstoffatome fehlen. Ursache ist mindestens eine Dreifachbindung. Das einfachste Alkin heißt Ethin und hat die Summenformel C2H2. Die allgemeine Summenformel für Alkine lautet CnH2n−2.
1. Ethin
Ethin (Acetylen) hat die Summenformel C2H2. Die Strukturformel ist H−C≡C−H. Schmelztemperatur: −81 °C. Siedetemperatur: −84 °C. (s). Acetylen sublimiert bei −84 °C, das heißt, es ändert seinen Aggregatzustand von fest (s) zu gasförmig (g). Nur unter bestimmten Druckverhältnissen schmilzt es bei −81 °C.
Propin
Propin (Propylen) hat die Summenformel C3H4.
Butin
Butin hat die Summenformel C4H6.
1.3 aromatische Kohlenwasserstoffe



Aromatische Kohlenwasserstoffe sind Verbindungen, die mindestens einen Benzolring enthalten. Sie sind gekennzeichnet durch ihren süßlichen, aromatischen Geruch - daher auch der Begriff aromatische Kohlenwasserstoffe
.
Aufbau des Benzol-Moleküls: Summenformel: C6H6 Strukturformel: Die Kohlenstoffatome sind in einem Sechseck angeordnet. C−C-Einzelbindungen wechseln sich mit C=C-Doppelbindungen ab. An jedem Kohlenstoffatom ist zudem noch ein Wasserstoff-Atom gebunden. Man kennzeichnet einen Benzolring innerhalb einer Verbindung durch ein regelmäßiges Sechseck mit einem eingeschriebenen Kreis. Weitere aromatische Verbindungen sind: Toluol, Styrol, Benzpyren, Biphenyl, Naphtalin.
2 Alkohol, organische Säuren und Ester



Die Schüler sollen
- die Herstellung von Trinkalkohol (Ethanol) beschreiben und durchführen
- die Nomenklatur der Alkanole und Isomerie beherrschen
- erklären, warum die Wirkung und Gefährlichkeit des Trinkalkohols auf den Menschen existiert
- den chemischen Aufbau von organischen Säuren beschreiben
- Eigenschaften und Verwendung von Estern nennen
2.1 alkoholische Gärung



Die alkoholische Gärung wird durch Hefen hervorgerufen. Diese Hefen wandeln den Zucker aus Früchten oder anderen zucker- bzw. stärkehaltigen Lebensmitteln um in Ethanol und Kohlenstoffdioxid.
Im Unterricht kann Wein recht einfach selbst hergestellt werden.
2.2 Alkanole



2.3 vom Wein zur Essigsäure



2.4 organische Säuren



2.5 Ester



3 Chemie und Ernährung



Die Schüler sollen
- sich über eine gesunde und bewusste Ernährung unterhalten
- ein gesundes Frühstück zusammenstellen
- versteckte Fette von lebenswichtigen Fetten unterscheiden
- beschreiben, welche Bedeutung Kohlenhydrate haben
- verschiedene Zucker und deren Eigenschaften nennen
- berichten, wie man Zucker gewinnen kann
- den generellen Aufbau von Eiweißen kennen
- über die enorme Bedeutung einer gesunden Ernährung berichten
3.1 Fette



Lipide = Fette Fettsäuren: gesättigt (tierische Fette) - ungesättigt (pflanzliche Fette) Chemie: Glycerin + 3 Fettsäuren −> Fett Vorkommen: Speck... Stichworte/Vermutungen: Kalorien, ungesättigte Fettsäuren nicht so kalorienreich, Energiebombe, ungesättigte Fettsäuren sind gesünder, Brennstoff, Mischbarkeit mit Wasser oder organischen Lösungsmitteln, Fett hat eine niedrigere Dichte als Wasser, schwimmt also oben Experimente: Fettfleckprobe, Extraktion von Fetten aus Ölsaaten
3.2 Kohlenhydrate



Kohlenhydrate = Zucker Einfachzucker (Monosaccharid): Glucose, Fructose - ringförmige Moleküle aus Kohlenstoff, Wasserstoff und Sauerstoff (z.B. C6H12O6) Zweifachzucker (Disaccharid): Saccharose, Lactose, Maltose - Verbindung aus zwei Einfachzuckern mit einem Sauerstoffatom als Verbindungsatom Mehrfachzucker (Polysaccharid): Stärke, Zellulose - Stärke ist eine spiralförmige Aneinanderreihung von Zuckermolekülen, Zellulose eine netzartige Verknüpfung von Zuckermolekülen Vorkommen: Brot, Nudeln, Reis, Kartoffeln... Stichworte/Vermutungen: Kalorien Experimente: Fehling-Probe, Stärkenachweis, Stärkespaltung
3.3 Eiweiße



Proteine - Eiweiße - Aminosäuren Vorkommen: Fisch, Ei Chemie: Peptidbindung Stichworte/Vermutungen: Energieträger Experimente: Biuret-Reaktion, Xanthoprotein-Reaktion
3.4 Vitamine, Mineralstoffe und Ballaststoffe



Vitamine Beispiele: Wasserlöslich: B (1-12), C, Folsäure Fettlöslich: A, D, E, K Vorkommen: Obst, Gemüse Mineralstoffe Beispiele: Salze Vorkommen: Mineralwasser, dunkles Brot, Gemüse, Gewürze Spurenelemente Beispiele: Magnesium, Calcium, Eisen, Kupfer, Zink,... Zusatzstoffe in Lebensmitteln Emulgatoren Konservierungsmittel Säuerungsmittel Geschmacksverstärker Lebensmittelgesetz
4 Seifen, Cremes und Wohlgeruch



Die Schüler sollen
- die Verseifungsreaktion beschreiben
- die Reinigungswirkung von Seifen und Tensiden erklären
- Umweltprobleme beim Einsatz von Waschmitteln nennen und Alternativen finden
- Kosmetika herstellen
4.1 Seife



- Herstellung von Seife Seifen werden aus Fett und Natronlauge bzw. Kalilauge hergestellt. Bei der Verseifungsreaktion bricht die Esterbindung zwischen dem Glycerin-Rest und den Fettsäuren auf. Die OH-Gruppe der Lauge reagiert mit dem Glycerin-Rest zu Glycerin-Molekülen. Die Natrium-Ionen Na+ bzw. die Kalium-Ionen K+ reagieren mit den Fettsäuren. Dadurch erhält die Fettsäure einen negativ geladenen Teil (die unvollständige Carboxylgruppe) und eine lange Kohlenwasserstoff-Kette, die unpolar ist. Dieses geladene Molekül nennt man Seifen-Anion. Seifen, die aus Natrium-Ionen und dem Seifen-Anion bestehen, nennt man Kernseife. Sie ist fest und hat eine hellgelbe Farbe. Ist hingegen ein Kalium-Ion am Seifen-Anion gebunden, so erhält man goldgelbe, zähflüssige Schmierseife.
- Aufbau des Seifen-Anions Seifen-Anionen bestehen aus einem hydrophilen, d.h. wasserliebenden Teil. An dieser COO−-Gruppe ist eine lange Kohlenwasserstoff-Kette gebunden. Diese Kette enthält üblicherweise 12 bis 17 Kohlenstoffatome und ist unploar. Daher ist sie wasserunlöslich (hydrophob) und fettliebend (lipophil). Seifen-Anionen vereinen in ihrem Molekül also zwei gegensätzliche Eigenschaften ähnlich eines Emulgators.
- Eigenschaften von Seifen
Das Seifen-Anion enthält einen wasserliebenden und einen fettliebenden Teil. Daher ist Seife sowohl wasserlöslich als auch fettlöslich. Seife zerstört die Oberflächenspannung des Wassers, wodurch zu reinigende Textil-Stoffe bzw. Oberflächen besser benetzt werden. Die lipophile Kohlenwasserstoff-Kette dringt in fettigen Schmutz ein (
Gleiches löst sich in Gleichem
). Der hydrophile Teil des Seifen-Anions ragt aus dem fettigen Schmutz heraus, wodurch das Schmutzteilchen eine hydrohile Oberfläche bekommt. Es wird wasserlöslich und von der Seifenlösung aufgenommen.
4.2 Tenside



Warum enthalten moderne Waschmittel keine Seife?
- Seife verursacht (bei hartem Wasser) einen grauen Schleier auf der Wäsche - Kalkseife: Hartes Wasser enthält viele Calcium Ca2+-Ionen und Magnesium Mg2+-Ionen. Wenn sich die Ca2+-Ionen mit dem wasserliebenden Teil der Seifen-Anionen verbinden, entsteht eine wasserunlösliche, graue Substanz, die sog. Kalkseife. Sie verursacht einen hässlichen grauen Schleier auf der Wäsche und besitzt keine Waschwirkung.
- Seifen greifen empfindliche Textilfasern aufgrund ihrer alkalischen Eigenschaften an. Wenn Textilfasern organische Stoffe enthalten (z.B. Baumwolle, Seide, Schafswolle, Kaschmere, Leinen), so werden sie von Laugen angegriffen, vergleichbar mit einem alkalischen Abflussreiniger.
- Ersatz durch preisgünstigere Tenside: Tenside werden in Fabriken aus Erdölprodukten preisgünstig hergestellt. Es werden keine Nahrungsfette vergeudet.
- in saurer Lösung besitzt Seife keine Waschwirkung: Säuren neutralisieren die alkalische Wirkung der Seife und verändern somit die Waschwirkung
- Seife überdüngt das Abwasser: Bakterien verwenden Seife als Nahrungsmittel und vermehren sich übermäßig stark, wenn viel Seife im Abwasser ist. Beim Wachsen entnehmen sie dem Wasser den Sauerstoff. Der Sauerstoff fehlt dann, der Fluss
kippt um
und stirbt.
Welche Inhaltsstoffe enthalten Waschmittel?
Moderne Waschmittel sind ein Gemisch aus vielen Substanzen, die alle eine bestimmte Wirkung bei der Wäsche erzielen sollen:
- Tenside: natürliche bzw. künstliche waschaktive Substanzen. Ähnlich wie Seife sorgen sie für das Ablösen des Schmutzes von der Faser.
- Enthärtungsmittel: Natriumaluminiumsilikate tauschen die Calcium-Ionen im Waschwasser gegen Natrium-Ionen aus. Dadurch sinkt die Wasserhärte und die Tenside können ihre volle Waschwirkung entfalten.
- Bleichmittel: Diese Substanzen zerstören Farbstoffe durch die Oxidiation mit Sauerstoff. Sie wirken erst bei einer Wassertemperatur von 95°C (Kochwäsche), um weiße Wäsche aufzuhellen.
- Enzyme: Enzyme (z.B. im Speichel) sind in der Lage, organische Verschmutzungen, wie z.B. Blut, Grasflecken, Rotwein usw. zu zerstören.
- optische Aufheller: Diese Stoffe sind im UV-Licht aktiv. Sie überziehen die Buntwäsche mit einer dünnen Schicht. Im UV-Licht (z.B. Sonnenlicht) leuchten sie bläulich. Zusammen mit dem gelben Schleier, den Wäsche üblicherweise überzieht, wirkt die Wäsche heller und weißer.
- Stellmittel: Früher enthielten viele Waschmittel, vor allem Pulver, Stellmittel, die dafür sorgten, dass das Waschpulver nicht verklumpte, sondern rieselfähig blieb.
- Parfumöle: Durch diese Öle duftet die Wäsche angenehm.
Was sind Tenside?
Tenside sind waschaktive Substanzen
. Ihr Molekülaufbau ist ähnlich wie der von Seife. Sie besitzen einen hydrophilen und einen lipophilen Teil, genauso wie das Seifen-Anion. Folgendermaßen hat man den hydrophilen Teil verändert:
- anionische Tenside: Die meisten Waschmittel enthalten anionische Tenside. Der hydrophile Teil des Tensids trägt eine negative Ladung, vergleichbar mit Seife.

- nichtionische Tenside: Diese Tenside tragen keine Ionenladung (z.B. Zuckertenside). Sie zeigen eine sehr gute Waschwirkung in hartem Wasser oder in Säuren.

- kationische Tenside: Sie finden Verwendung in Weichspülern, da ihr ionisierter Teil eine positive Ladung trägt. Ihre Waschwirkung ist jedoch nur gering.

- amphotere Tenside: In vielen kosmetischen Produkten kommen diese Tenside zum Einsatz. Der hydrophile Teil trägt sowohl eine positive als auch negative Ladung.

Wie kann man Waschmittel, Energie und Wasser sparen, ohne an der Sauberkeit zu sparen?
- Shampoo: Die Wirkstoffe im Shampoo sind ähnlich wie die im Waschmittel, es fehlen jedoch Aufheller und Bleichmittel. Die Dosierung muss vorsichtig herausgefunden werden, da Shampoo stark schäumt. Shampoos sind teurer als Waschmittel...
- Wasserenthärter: Durch einen Ionentauscher werden die Ca-Ionen durch Na-Ionen ausgetauscht. Dadurch entsteht beim Waschen keine Kalkseife. Die benötigte Seifenmenge bzw. Waschmittelmenge kann also verringert werden. Der Ionentauscher wird direkt an die Trinkwasserzuleitung angeschlossen und enthärtet somit das gesamte Trinkwasser im Haus.
- Härtegrad des Wassers berücksichtigen: Nur wenn man den Härtegrad des Wassers kennt, kann man das Waschmittel entsprechend dosieren. Den Härtegrad des Wassers kann man bei der Gemeinde/Stadt oder dem Wasserversorger (Webseite) erfragen.
- Wäsche einweichen: Viele Waschmaschinen besitzen ein
Einweichprogramm
. Die Wäsche bleibt für längere Zeit in der Waschlauge liegen, dadurch erhalten die waschaktiven Substanzen mehr Zeit, die Flecken zu lösen. Bestehen die räumlichen Voraussetzungen kann man die Waschlauge aus der Waschmaschine in einem Becken oder einer großen Wanne sammeln und diese Lauge zum Einweichen verwenden. - Ökowaschball: Ein Ball mit einer seltsamen Mineralfluidfüllung soll den Waschmittelbedarf senken. Man muss daran glauben... Ausprobieren schadet nicht.
- Waschnussschalen: Diese Nussschalen enthalten natürliche waschaktive Substanzen, die nach und nach bei jeder Wäsche abgebenen werden. Dadurch kann man Waschmittel einsparen oder sogar komplett darauf verzichten. Die Kosten sind jedoch recht hoch.
- Waschbeutel: Die Wäsche wird nicht lose in die Waschtrommel gegeben, sondern in einen Beutel. Das Waschmittel kann sich so besser in der Waschlauge verteilen und sich nicht zwischen den Wäschestücken ansammeln, wo es helle Flecken hinterlassen würde.
- Seifenkraut: Diese Pflanze enthält natürlicherweise waschaktive Substanzen. Sie sind ökologisch gut abbaubar, aber sehr teuer.
- Waschkonzentrat: Moderne Waschmittel sind häufig hochkonzentriert und enthalten kaum noch Füllstoffe. Die benötigte Menge ist also wesentlich geringer als bei früheren Waschmitteln. Man sollte also die Waschmittelmenge so weit reduzieren, bis man mit einer minimalen Waschmittelmenge die erwünschte Waschwirkung erzielt.
- Häufigkeit der Wäsche: Wäsche nur dann waschen, wenn sie auch wirklich dreckig ist.
- Komplexbildner: Bestimmte Salze bzw. Mineralien binden die Ca-Ionen bzw. Mg-Ionen und bilden
Komplexe
. Dadurch kann Waschpulver eingespart werden, da das Wasser weicher wird. - Waschmittel in die Wäsche geben: Dadurch wirken die Tenside des Waschmittels direkt auf die Wäsche.
- Wäsche wiegen: Waschmittel kann besser dosiert und dadurch gespart werden.
- Volle Waschmaschine: Das gesamte Wasser, sowie Waschmittel und Strom werden ausgenutzt.
- Rosskastanien: Sobald sie kleingeschnitten sind und in Verbindung mit heißem Wasser geraten, entwickelt das Wasser eine Waschwirkung. Die heimische Rosskastanie enthält waschaktive Substanzen, die sogenannten Saponine.
- Wäsche lüften anstatt zu waschen: Dadurch wird das Waschpensum reduziert.
- Niedrigere Waschtemperatur: Unsere modernen Waschmittel entwickeln schon ab niedrigen Temperaturen eine Waschwirkung, da sie fast keine Bleichmittel mehr enthalten.
4.3 Parfums und Kosmetika



Herstellung von Duftstoffen
Folgende Methoden werden zur Gewinnung von Duftstoffen verwendet:
- Enfleurage: Bei der sogenannten Fettextraktion werden empfindliche Duftstoffe, z.B. Blütenblätter, auf ein Bett aus gereinigten Fett (z.B. Schweineschmalz) gelegt. Die etherischen Öle wandern ins Fett, bis es gesättigt ist. Solange werden die ausgelaugten Blütenblätter ersetzt. Das gesättigte Fett wird anschließend vom Duftstoff getrennt, indem man es in Ethanol legt. Die Duftstoffe lösen sich dann im Ethanol.
- Mazeration: Die den Duftstoff enthaltene Substanz (z.B. Blüten) wird in eine Flüssigkeit (z.B. gereinigtes Öl) eingelegt. Die Flüssigkeit löst die Duftstoffe, bis sie gesättigt ist. Anschließend wird der Duftstoff vom Lösungsmittel getrennt (z.B. durch Destillation).
- Destillation: Ein flüssiges Gemisch aus dem Duftstoff und mindestens einem Lösungsmittel wird bis zum Siedepunkt des Duftstoffes erhitzt, der dann verdampft. Im Kühler kondensiert der Duftstoff und gelangt als gereinigtes Destillat in die Vorlage.
- Expression: Wenig empfindliche Duftstoffe werden in einer Presse aus der Frucht, z.B. der Zitrone, herausgepresst und anschließend abfiltriert.
- Extraktion: Mithilfe eines geeigneten Lösungsmittels wird der Duftstoff z.B. aus der Pflanze herausgelöst. Der Duftstoff ist dann im Lösungsmittel gelöst und kann mithilfe der Destillation vom Lösungsmittel getrennt werden.
- Synthetische Duftstoffe: Ist die chemische Struktur eines synthetischen Duftstoffes bekannt, so werden mithilfe von geeigneten chemischen Reaktionen aus ähnlichen Grundchemikalien (vor allem aus Erdöl) der synthetische Duftstoff synthetisiert.
Herstellung von Lösungsmitteln
In den meisten Parfums sind die Lösungsmittel Ethanol und Wasser enthalten. Der Industriealkohol wird durch den natürlichen Gärprozess und anschließender Destillation im großtechnischen Maßstab produziert. Das Wasser muss von allen Verunreinigungen gereinigt werden: VE-Wasser. Vollentsalztes Wasser wird aus Trinkwasser gewonnen, indem man das Wasser durch einen Ionenaustauscher laufen lässt. Im Ionenaustauscher werden die Ca2+- und die Mg2+-Ionen durch H+-Ionen ersetzt.
Herstellung des eigentlichen Parfums
Das Parfümöl ist der eigentliche Grundbaustein des Parfüms. Dem Parfümeur stehen ca. 2000 Duftbausteine zur Verfügung, aus welchen das Parfümöl komponiert wird. Zur Herstellung des Parfümöls werden einzelne Duftstoffe im Labor miteinander vermischt, getestet, verbessert oder sogar verworfen, falls es den Ansprüchen des Parfümeurs nicht entspricht. Das Auswahlverfahren ist meist zeitaufwändig und für den Hersteller finanziell belastend. Sobald das Parfüm allen Kriterien entspricht, beginnt die Massenproduktion. Das Rezept wird zunächst in einen Mischbetrieb geschickt und dort angemischt. Die gewünschte Duftmischung wird in Alkohol und etwas destiliertem Wasser gelöst. Von da an beginnt die Reifung in Holzfässern. Nach Abschluss dieses Vorgangs füllt man das fertige Parfüm in ansprechende Glasfläschchen. Im Handel werden diese Flaschen, deren Inhalt einen Wert von wenigen Cent hat, für viele Euro verkauft.
Parfum
- Kopfnote: Die Kopfnote ist verantwortlich für den ersten Eindruck des Parfums - der Duft verfliegt bereits wenige Minuten nach dem Auftragen auf die Haut. Die Duftstoffe, die für die Kopfnote verantwortlich sind, sind leicht flüchtig, aber intensiv duftend. Beispiele: Zimt, Blutorange, Limette, Klementinen
- Herznote: Das Herzstück eines Parfums ist der Duft, der nach dem Verfliegen der Duftstoffe der Kopfnote über mehrere Stunden den eigentlichen Duft des Parfums bestimmt. Die Duftstoffe, welche die Herznote bestimmen, bestehen in der Regel aus nicht so leicht flüchtigen Molekülen, wodurch mehrere Stunden vergehen, bis das letzte Molekül verdunstet ist. Beispiele: Eisenkraut, Fenchel, Honig, Iris, Pfeffer
- Basisnote: Die Duftstoffe der Basisnote werden zuletzt wahrgenommen. Sie haften am längsten auf der Haut und sind am schlechtesten flüchtig. Beispiele: Vanille, Weihrauch, Jasmin
5 Organische Werkstoffe



Die Schüler sollen
- Herstellung und Verwendung des wichtigsten Werkstoffes unserer Zeit beschreiben
- die Wirkung von verschiedenen Kunststoffen darstellen
5.1 Holz und Naturfasern



5.2 Kunststoffe, Gummi und Chemiefasern



Kunststoffe Gummi Kunstfasern
5.3 Klebstoffe



5.4 Chemie rund um das Auto



Treibstoffe
- Siehe Kapitel Saurer Regen
Motoren
- Siehe Kapitel Saurer Regen
Abgase
- Siehe Kapitel Saurer Regen
Katalysatoren
- Siehe Kapitel Saurer Regen
Spezialgläser
- Verbundglas: Verbundgläser werden im Automobilbau hauptsächlich bei der Frontscheibe eingesetzt. Eine dünne, farblose Kunststofffolie wird zwischen zwei Glasscheiben geklebt. Dadurch zerbricht die Scheibe nicht, sondern zersplittert, wobei die Kunststofffolie die Glassplitter festhält. Erzielt wird dadurch eine geringere Gefährdung der Fahrzeuginsassen und eine höhere Stabilität der Glasscheibe gegen Steinschlag.
- Sicherheitsglas: Glas wird bei der Herstellung schnell erhitzt und wieder abgekühlt, so dass Spannungen im Glas entstehen. So zerbirst es nicht in scharfkantige Splitter, sondern in kleine, recht ungefährliche, meist runde Glassplitter. Die Seitenscheiben und die Rückscheibe bei den meisten Autos bestehen aus diesem Sicherheitsglas. Es soll einen Notausstieg ermöglichen, was durch den Einsatz von Verbundglas an diesen Stellen erschwert werden würde.
Keramiken Kunststoffe
- Siehe Kapitel Kunststoffe
Kunstfasern
- Sitzbezüge der meisten PKW bestehen aus Kunstfasern, da diese sehr reißfest sind. Außerdem lassen sie Wärme und Feuchtigkeit leicht hindurch, was einen angenehmeren Sitzkomfort ermöglicht. Kunstfasern bestehen aus Kunststoffen, die fein versponnen werden. Die Kunststoffe werden zu diesem Zweck geschmolzen und durch sehr feine Düsen gepresst. Bekannte Kunstfasern sind Polyester oder Polyacryl.
Reifen
- Siehe Kapitel Kunststoffe
Klebstoffe
- Siehe Kapitel Klebstoffe
Metalle