Informationen zum Element: Brom
| Chemische Daten, Vorkommen, Verwendung, Bilder | nicht eingeloggt |
Steckbrief: Brom
Informationen zum Element:
Bezeichnung
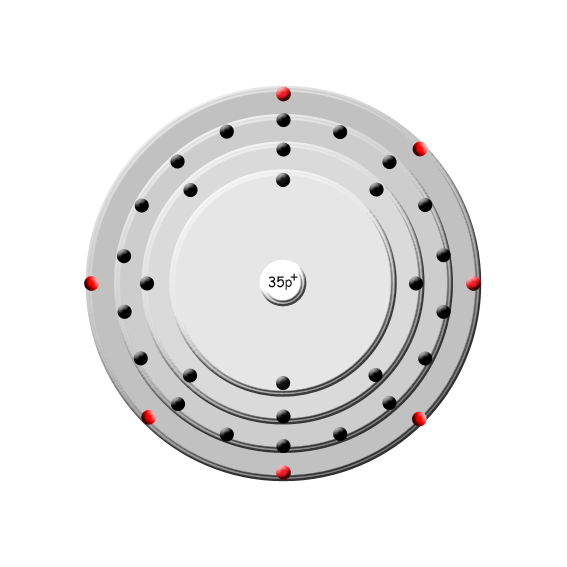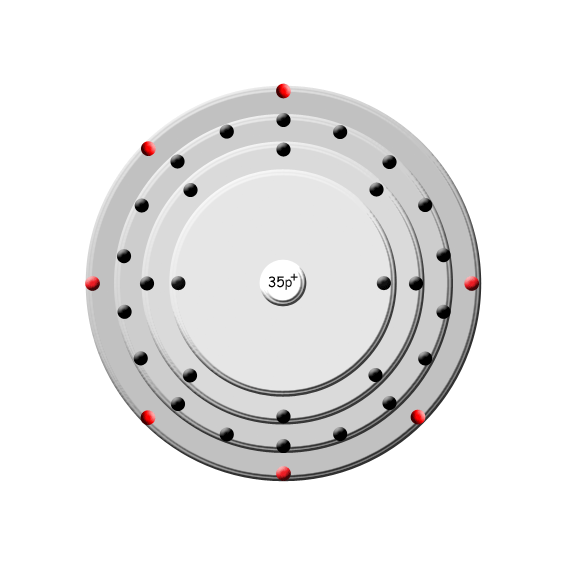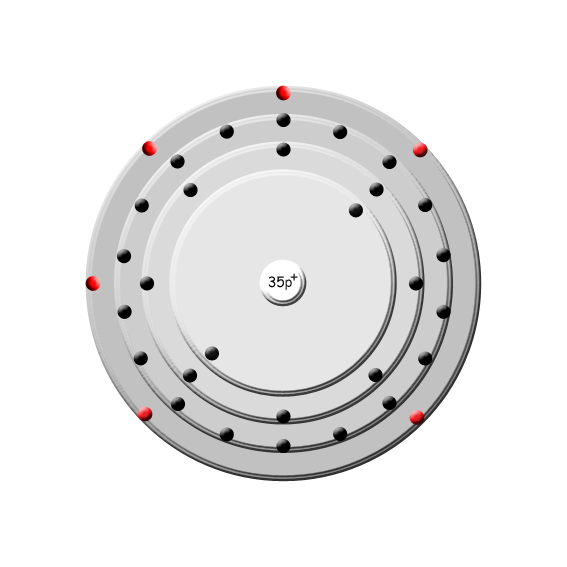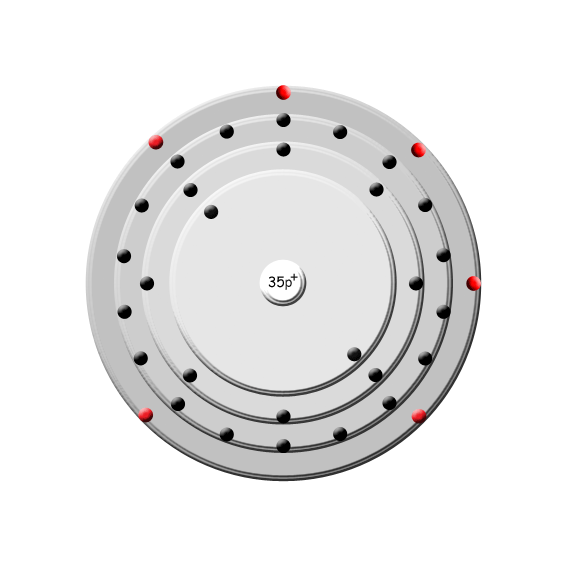
Symbol: Br
Internationale Bezeichung (IUPAC): Bromine
Ursprung: Brom (von griech. brômos Gestank
; wegen des beißenden Geruchs von Bromdämpfen) ist ein chemisches Element mit dem Symbol Br und der Ordnungszahl 35. Im Periodensystem der Elemente steht es in der 7. Hauptgruppe und gehört damit zu den Halogenen.
Brom und Quecksilber sind die einzigen Elemente, die unter Normalbedingungen flüssig sind.
Brom wurde 1826 erstmals durch den französischen Chemiker Antoine-Jérôme Balard aus Meeresalgen der Salzwiesen bei Montpellier chemisch hergestellt. Eine industrielle Produktion erfolgte ab 1860. Aufgrund seines stechenden Geruchs schlug Joseph Louis Gay-Lussac den Namen Brom
(von griech. Bocksgestank der Tiere
) vor.
Bereits zwei Jahre vor Balard stellte der deutsche Chemiker Justus von Liebig 1824 unbewusst elementares Brom her. Er hatte den Auftrag, die Salzsolen von Salzhausen zu analysieren, da die Stadt ein Kurbad plante. Bei der Untersuchung dieser Sole fand Liebig eine neue Substanz, die er als Iodchlorid deutete. 13 Jahre später gab er zu, dass ihn seine nachlässige Analyse um die Entdeckung eines neuen Elements gebracht hätte. Liebig schrieb dazu: Ich kenne einen Chemiker, der, als er in Kreuznach war, die Mutterlaugen der Saline untersuchte.
Im weiteren beschrieb er dann sein Missgeschick und schloss mit den Worten: Seit dieser Zeit hat er keine Theorien mehr aufgestellt, wenn sie nicht durch unzweifelhafte Experimente unterstützt und bestätigt wurden; und ich kann vermelden, dass er daran nicht schlecht getan hat.
Bedeutung: brômos = Bocksgestank der Tiere
Daten Periodensystem
Periode: 4
Gruppe: 17 (VII A)
Gruppenname: Halogene
Oxidationszahl: -1 (7, 5, 3, 1)
Atommasse [u]: 79,904
Elektronegativität
Elektronegativität (nach Allred): 2,7
Elektronegativität (nach Pauling): 2,96
Physikalische Daten

Aggregatzustand (20°C): flüssig
Dichte [g/cm2]: 3,122
Radioativ: n
Schmelztemperatur [°C]: -7,15
Siedetemperatur [°C]: 59
Kristallstruktur: orthorhombisch
Verwendung im Alltag
- Eigenschaften: Die Dichte von Brom ist 3,12 g/cm3. Die schwere rotbraune Flüssigkeit bildet unangenehm stark stechend riechende Dämpfe, die giftiger sind als Chlor. Festes Brom ist dunkel, bei weiterer Abkühlung hellt es auf. In Wasser ist es mäßig, in organischen Lösungsmitteln wie Alkoholen, Kohlenstoffdisulfid oder Tetrachlorkohlenstoff sehr gut löslich. In Wasser gelöstes Brom reagiert langsam unter Zwischenbildung von hypobromiger Säure (HBrO) und Sauerstoffabgabe zu Bromwasserstoff (HBr). Die kinetisch gehemmte Reaktion wird durch (Sonnen-)Licht beschleunigt, Bromwasser wird daher in braunen, wenig lichtdurchlässigen Flaschen aufbewahrt. Brom verhält sich chemisch wie das leichtere Chlor, reagiert aber im gasförmigen Zustand weniger energisch. Feuchtigkeit erhöht die Reaktivität des Broms stark.
- Reaktionen: Mit Wasserstoff reagiert es im Gegensatz zum Chlor erst bei höheren Temperaturen unter Bildung von Bromwasserstoff (farbloses Gas).
Br2 + H2 --> 2 HBr
Mit vielen Metallen (z.B. Aluminium) reagiert es exotherm unter Bildung des jeweiligen Bromides. Feuchtem Brom widerstehen nur Tantal und Platin. - Verwendung:
- Chemisches Polieren von Galliumarsenid (als Lösung in Methanol)
- mehrfach bromierte Biphenyle bzw. Diphenylether als Flammschutzmittel für Leiterplatten. Im Jahr 2000 wurden 38 % des Broms für die Herstellung von bromierten Flammschutzmitteln verwendet.
- Methylbromid als Schädlingsbekämpfungsmittel
- Desinfektionsmittel (milder als Chlor)
- in Form von Bromiden, beispielsweise Kaliumbromid, als Arzneimittel (Narkose-, Beruhigungs- und Schlafmittel; Behandlung therapieresistenter Epilepsien mit generalisiert tonisch-klonischen Anfällen, früher sehr beliebt – heute obsolet)
- Fotoindustrie (Silberbromid als Bestandteil der lichtempfindlichen Suspension)
- Alkalihypobromite als Bleichmittel
- im Labor als Indikator (ungesättigte Kohlenstoffverbindungen entfärben Bromwasser, d.h. Addition von Brom)
- Bromate als Oxidationsmittel
- Bromhaltiger Kautschuk zur Herstellung
luftdichter
Reifen - Tränengas z.B. in Form von Monobromaceton
- in Mitteln zum Schutz gegen das Nervengas Soman bei US-Soldaten im Irak-Krieg
- Früher in Form von Alkylbromiden als Scavenger zum Entfernen des Bleis aus Zylindern bei der Nutzung von verbleitem Benzin
Vorkommen und Häufigkeit
Vorkommen: Natürlich kommt Brom als Bromide, den Salzen der Bromwasserstoffsäure, vor. Massenmäßig finden sich die größten Vorkommen als gelöste Bromide im Meerwasser. Auch Vorkommen natürlicher Salzlagerstätten (Stein- und Kalisalze) enthalten geringe Anteile an Kaliumbromid und Kaliumbromat.
Die industrielle Herstellung elementaren Broms erfolgt durch Oxidation von Bromidlösungen durch Chlor. Als Bromidquelle nutzt man überwiegend Meerwasser, vereinzelt auch Sole, stark salzhaltiges Wasser aus großer Tiefe. Eine Gewinnung aus den Restlaugen der Kaligewinnung ist nicht mehr wirtschaftlich. Seit 1961 hat sich die jährlich gewonnene Menge an Brom von rund 100.000 Tonnen auf über eine halbe Million Tonnen mehr als verfünffacht.
Im Labor kann Brom durch Umsetzung von Natriumbromid mit Schwefelsäure und Braunstein in der Hitze dargestellt werden. Das Brom wird dabei durch Destillation abgetrennt.
Häufigkeit: 6,00 ⋅ 10-4 % (prozentualer Massenanteil der Erdhülle, d.h. der Erdkruste/Ozeane bis 16 km Tiefe)
Geschichte
Entdeckung: 1826
Entdecker: Antoine-Jérôme Balard
Isotope
- 79Br (50,69 %, stabil, 44 Neutronen)
- 81Br (49,31 %, stabil, 46 Neutronen)
Bild (mit freundlicher Genehmigung von http://www.smart-elements.com):